RAC-USの迅速なアップデート対応
RAC-US試験に変更がございました場合は、現在の試験と一致するよう、瞬時に学習資料を更新することができます。弊社は、お客様に最高、最新のRAPS RAC-US問題集を提供することに専念しています。なお、ご購入いただいた製品は365日間無料でアップデートされます。
RAC-US試験の品質と価値
JPNTestのRAC Regulatory Affairs Certification RAC-US模擬試験問題集は、認定された対象分野の専門家と公開された作成者のみを使用して、最高の技術精度標準に沿って作成されています。
JPNTestでRAPS RAC-US問題集をチョイスする理由
JPNTestは、1週間で完璧に認定試験を準備することができる、忙しい受験者に最適な問題集を提供しております。 RAC-USの問題集は、RAPSの専門家チームがベンダーの推奨する授業要綱を深く分析して作成されました。弊社のRAC-US学習材料を一回のみ使用するだけで、RAPS認証試験に合格することができます。
RAC-USはRAPSの重要な認証であり、あなたの専門スキルを試す認定でもあります。受験者は、試験を通じて自分の能力を証明したいと考えています。 JPNTest Regulatory Affairs Certification (RAC) US は、RAC Regulatory Affairs Certificationの100の問題と回答を収集して作成しました。Regulatory Affairs Certification (RAC) USの知識ポイントをカバーし、候補者の能力を強化するように設計されています。 JPNTest RAC-US受験問題集を使用すると、Regulatory Affairs Certification (RAC) USに簡単に合格し、RAPS認定を取得して、RAPSとしてのキャリアをさらに歩むことができます。
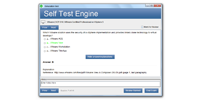
ダウンロード可能なインタラクティブRAC-USテストエンジン
RAC Regulatory Affairs Certificationの基礎準備資料問題集には、RAC Regulatory Affairs Certification RAC-US試験を受けるために必要なすべての材料が含まれています。詳細は、正確で論理的なものを作成するために業界の経験を常に使用しているRAC Regulatory Affairs Certification によって研究と構成されています。
あなたのRAC-US試験合格を100%保証
JPNTestテスト問題集を初めて使用したときにRAC Regulatory Affairs Certification RAC-US試験(Regulatory Affairs Certification (RAC) US)に合格されなかった場合は、購入料金を全額ご返金いたします。
RAPS Regulatory Affairs Certification (RAC) US 認定 RAC-US 試験問題:
1. A company's product was approved by a regulatory authority with the condition that further studies must be completed prior to full approval of the product.
To minimize product-associated risk to patients during the period of conditional approval, what is the LEAST effective way to achieve this goal?
A) Promote off-label use to a carefully selected patient population.
B) Delay product launch until required studies are completed.
C) Label the product for use in appropriate populations.
D) Educate patients and healthcare providers on how to use the product
2. Which of the following double-blind clinical trial designs would be MOST appropriate for a
Phase III study with a new product intended to treat an acute life-threatening disease with less than optimal available therapy?
A) Dose-ranging
B) Cross-over
C) Active-controlled
D) Placebo-controlled
3. After submission to the regulatory authority, a substantial error was found in the application. In order to resolve this issue, what should be done FIRST?
A) Verify the procedure in the regulation for the corrections.
B) Contact the legal department and ask them how to proceed.
C) Resubmit the entire package.
D) Inform upper management immediately.
4. Company X is planning to acquire the rights for a product marketed by Company Y.
As part of due diligence, what is the MOST important information the Company X regulatory affairs professional should ask senior management to request from Company Y?
A) Clinical trial data
B) Safety issues
C) Intellectual properly
D) Marketing materials
5. Which of the following is NOT considered a serious adverse event in a cardiovascular clinical trial?
A) Subject is hospitalized for the purpose of product administration.
B) Subject's hospitalization is due to an unscheduled hip operation.
C) Subject's hospitalization is prolonged during the clinical trial.
D) Subject is hospitalized due to complications of the product administration.
質問と回答:
| 質問 # 1 正解: A | 質問 # 2 正解: B | 質問 # 3 正解: A | 質問 # 4 正解: B | 質問 # 5 正解: A |


 227 お客様のコメント
227 お客様のコメント